第148期中間期事業活動のご報告 | 武田薬品

第148期中間期事業活動のご報告
私たちのパーパス(存在意義)は、世界中の人々の健康と、輝かしい未来に貢献することです。サイエンスや技術が進化しても、揺るぎない価値観に基づいた私たちの志は変わりません。人々の暮らしを豊かにする医薬品をお届けし、社会に貢献するとともに、従業員が理想的な働き方を実現できる環境づくりに努めています。
株主の皆さまへ
日頃からのご支援と信頼に心より感謝申しあげます。2024年度上期を振り返ると、成長製品・新製品が力強い勢いで成長するとともに、後期開発段階のパイプラインも順調に進展しました。複数年にわたる効率化プログラムを進めていることに加え、マイルストンや財務的な目標を達成し、ステークホルダーの皆さまへの長期的な価値創出に向けて前進しています。当社は、想定よりも力強い上期業績を反映し、2024年度通期のマネジメントガイダンスを上方修正しました。当上期における進捗に満足するとともに、持続的な成長へ回帰するための道筋に自信を深めています。
下記をクリックして続きを読む

FRUZAQLA®(国内製品名:フリュザクラ®)(一般名:フルキンチニブ)やADZYNMA®(国内製品名:アジンマ®)(一般名:アパダムターゼ アルファ(遺伝子組換え)/シナキサダムターゼ アルファ(遺伝子組換え))、 EOHILIA®(一般名:ブデソニド経口懸濁液)など直近で上市した新製品は、それぞれに力強い立ち上がりを示しており、これら製品が患者さんのニーズを満たしうる製品として今後の成長性を物語っています。欧州におけるアジンマおよび日本におけるフリュザクラの承認など、これらの新製品は地理的な拡大を通じて成長し続けていくと見込んでいます 。加えて、重要なこととして当上期において、ENTYVIO®(国内製品名:エンタイビオ®)(一般名:ベドリズマブ)が主に米国でのENTYVIO Pen(皮下投与製剤)の上市に牽引される形で、再び二桁台の成長率に戻りました。ENTYVIOの上市から10年が経過した今、非常に激しい市場競争環境下において、二桁台の成長率に戻ったことは際立った成果といえます。他方、これは期初の想定を下回る成長率であり、炎症性腸疾患市場全体の伸びが低調であったこと、また製剤への患者さんのアクセスが想定よりも遅れたことが影響しました。しかし、2024年7月以降、米国ではアクセスは飛躍的に向上しており、当社は引き続きアクセス改善に注力していきます。
2024年5月に発表した複数年にわたる効率化プログラムは、計画通りに進捗しています。組織の機動性を高めるため、本社および各地域の部門における組織構造改革を行ったほか、調達コストの削減をもたらすさまざまな取り組みを実施しました。さらに、当社はバリューチェーン全体にわたる効率性と生産性の向上を図るため、引き続きデータ・デジタル&テクノロジーの活用に注力しています。
同時に、当社は将来の成長に寄与する革新的なパイプラインへの投資を続けており、現在、複数のプログラムが第3相臨床試験 の開発段階にあります。これらの後期開発段階のプログラムは、ナルコレプシータイプ1や乾癬のほか、より有病率が高い疾患や希少疾患など高い医療ニーズが存在する疾患に対して有効な治療薬となりうるものです。 当社のパイプラインの革新性および将来的にもたらしうる価値に期待しており、12月13日に予定しているR&D Dayにおいて、その詳細を皆さまと共有できることを楽しみにしています。
下期以降も、継続して成長製品・新製品が力強い成長を遂げるとともに、有望なパイプラインの進展が続くと想定しています。革新的な医薬品を創出し、患者さんにお届けするため引き続き尽力してまいりますので、皆さまのご支援をよろしくお願いいたします。
武田薬品工業株式会社
代表取締役社長CEO

クリストフ・ウェバー

特集
ナルコレプシーに対する革新的な治療薬の創出を目指して
ナルコレプシーは生活の質を著しく低下させる慢性疾患1で、仕事や学業、そして人間関係に深刻な影響を及ぼします。しかし、その深刻さにも関わらず、ナルコレプシーは周りに理解されず、あまり注目されていません。当社は、オレキシンの研究開発プログラムを通じ、この希少な疾患に苦しむ人々に革新的な治療薬をお届けすることを目指しています。
下記をクリックして記事全文を読む
診断の遅れも患者さんの重い負担に
ナルコレプシーには2つのタイプがあります。オレキシンニューロン(神経細胞)の著しい減少によってオレキシンが不足するナルコレプシータイプ1(NT1)と、オレキシン濃度が概ね正常な水準にあるナルコレプシータイプ2(NT2)です。NT1の患者さんは、日中の過度の眠気、感情が高まったときに急に力が抜ける情動脱力発作(カタプレキシー)、夜間の睡眠障害、入眠時幻覚、睡眠麻痺、認知障害、疲労1など、生活を著しく妨げるさまざまな症状に苦しんでいます。患者さんの負担は、これらの症状により、社会生活、学校や仕事でのパフォーマンス、集中力の維持、運動や家事、運転の際などにも影響が及ぶことがあります。2不自由な日常生活や絶えず襲ってくる眠気、症状に対する周りの理解不足からの孤立感や疾患へのネガティブな評価は、心理面および感情面で患者さんの健康に深刻な影響を与えます。加えて、症状が他の病気によるものと重なって見落とされたり、単なる睡眠不足と見なされたりすることがあり3,4、正確な診断がなされるまでに平均10年以上かかります。2,3,5NT1の症状はそのタイプや深刻さによって大きく異なり、疾患への認識の欠如や誤解のため、より一般的な症状と捉えられてしまい、見過ごされることもあります。
NT1が一人の患者さんの生活に及ぼす影響についてはこちら、また正確な診断の改善に向けたウェアラブル端末の可能性についてはこちらを参照ください。
新たな標準治療(※1)となる可能性
NT1の患者さんはオレキシンニューロンの消失により、オレキシンの供給が不足し、それに伴う神経伝達物質の活性の低下が見られます。1 これにより、睡眠と覚醒の周期が乱れ、意図しない睡眠が誘発されることがあります。
神奈川県の湘南にある当社の研究施設にて発見されたTAK-861(※2)は、オレキシン2受容体 に結合し、NT1の患者さんの神経伝達物質の活性を刺激する臨床開発段階にある経口のオレキシン2受容体作動薬の候補薬です。6 既存治療薬では、NT1の根本的な病態生理に対処するものが現時点ではありません。他方、TAK-861はNT1の持つ根本的な特性に対処するようデザインされた、初めての薬剤になると期待しています。TAK-861は、病気を引き起こす根本的な原因に取り組むことで、NT1によるさまざまな症状のほか、患者さんが抱える機能面での影響を含めた負担を改善することを目指しており、最終的には新しい標準治療となる可能性を秘めています。
現在、第3相臨床試験が進行中
2024年6月と9月に開催された、睡眠医学・研究の分野の医学会で発表された第2b相臨床試験データ6は、開発中のTAK-861がプラセボと比較して、覚醒状態の維持や情動脱力発作の持続的な減少を有意に示しました。 また、認知機能や睡眠の質など日常生活でのTAK-861による改善のほか、治療開始後1年を経過した患者さんでの長期的な安全性と有効性も明らかになりました。6 同年8月には、NT1に対するTAK-861 の第3相臨床試験が開始されました。当社はさらに、日中の過度の眠気などNT1と同じ症状があるものの、NT2や特発性過眠症(IH)を含むオレキシンが概ね正常な水準にある他の希少な睡眠障害に対する治療薬の開発も進めています。例えば、NT2およびIHを対象とし、開発中のもう一つの経口のオレキシン2受容体作動薬のTAK-360(※2)は、現在、健康な被験者を対象とした第1相臨床試験が進行中です。
当社は、革新的な治療薬の創出だけでなく、デジタルやデータの活用を通じ、ナルコレプシー等の診断を進化させることで、疾患の発症から治療の管理とその結果に至るプロセス全体に渡り、いまだ満たされていない患者さんのニーズにも包括的に取り組んでいきます。
“学会などの場で発表を行うたび、NT1の治療薬としてファースト・イン・クラスの可能性を有するTAK-861に対し、ほかの研究者からの期待を感じます。チームが一丸となり、患者さんが必要とする治療薬を確実にお届けすべく取り組んでいます。”
湘南研究施設のニューロサイエンス創薬ユニットにてオレキシン領域の研究をリードする木村温英
当社のパイプラインについては、2024年12月13日開催のR&D Dayでさらに詳しく説明します。当イベントでは、後期開発段階プログラムについて深掘りし、これらの候補薬によって改善する可能性のある症状に悩む患者さんのため、なぜ新しい治療選択肢をお届けする必要があるのか、どのような第3相臨床試験を計画しているのか、その試験期間や競争優位性、商業的な見通しについてお話しします。 後日、当社ウェブサイトにアーカイブ配信の動画とプレゼンテーション資料を掲載します。
※1 科学的根拠に基づき、医学の専門家が、その判断する時点において医学的に最も推奨するというコンセンサス(合意)の得られている治療法のことをいいます。※2 TAK-861とTAK-360は現在開発中の化合物であり、上記の適応症ではどの規制当局からも承認されていません。また、どの適応症においても承認されることを保証するものではありません。
参考文献
1. Scammell TE (2015) Narcolepsy. N Engl J Med 373(27):2654–2662, ICSD-3 TR - Disorders of central hypersomnolence
2. Maski K, et al. J Clin Sleep Med. 2017;13(3):419-425. doi: 10.5664/jcsm.6494; 6. US FDA. Narcolepsy & Idiopathic Hypersomnia: FDA Patient-Led Listening Session Summary Report
3. Luca G, et al. J Sleep Res. 2013;22(5):482-495. doi: 10.1111/jsr.12044;
4. Ohayon MM, et al. Sleep Med. 2021;84:405-414. doi: 10.1016/j.sleep.2021.06.008.
5. Telt sch DY, et al. Poster (P296) presented at: The 38th Annual Meeting of the Associated Professional Sleep Societies; June 1-5, 2024; Houston, TX, USA;
6. Dauvilliers Y. Oral presentation (LBA1318) at: The 38th Annual Meeting of the Associated Professional Sleep Societies; June 1-5, 2024; Houston, TX, USA
2024年度上期業績について
2024年度上期の好調な業績は、恒常為替レート(CER)ベースで前年同期比+18.7%成長し、売上収益全体の47%を占める成⾧製品・新製品*が継続して牽引したことによります。上期の業績には 、後期開発段階のプログラムの進展に伴い、下期に当初計画通りの増加を見込む研究開発費の期ずれも貢献しています。Core売上収益とCore営業利益は、CERベースでそれぞれ同+5.0%と同+12.9%増加しました。他方、財務ベースの営業利益は主に前年度に計上した非中核項目の影響により、実勢レート(AER)で同+194.0%増加しました。
*タケダの成長製品・新製品の定義については当社の2024年度上期決算説明会プレゼンテーション資料https://www.takeda.com/jp/investors/financial-results/quarterly-results/のスライド5をご参照ください。(億円、EPSを除く)
| 科目 | 2024年度上期 | 2023年度上期 | 対前年同期(AERベースの増減率) |
|---|---|---|---|
| 売上収益 | 23,840 | 21,017 | +13.4% |
| 営業利益 | 3,506 | 1,192 | +194.0% |
| 当期利益 | 1,873 | 414 | +352.8% |
| EPS (円) | 119 | 27 | +348.4% |
| 営業活動によるキャッシュ・フロー | 4,513 | 2,913 | +54.9% |
| 調整後フリー・キャッシュ・フロー(IFRSに非準拠) | 2,475 | △711 | N/A |
地域別売上収益
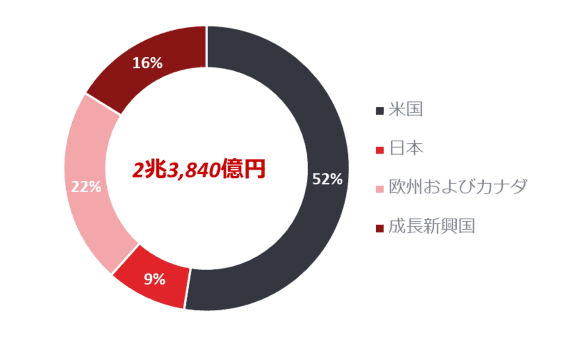
Coreベース(IFRSに非準拠)
(億円、EPSを除く)
| 科目 | 2024年度上期 | 2023年度上期 | 対前年同期 (AERベースの増減率) | 対前年同期 (CERベースの増減率) |
|---|---|---|---|---|
| 売上収益 | 23,840 | 21,017 | +13.4% | +5.0% |
| 営業利益 | 7,199 | 5,888 | +22.3% | +12.9% |
| 営業利益率 | 30.2% | 28.0% | +2.2pp | ― |
| 当期利益 | 4,891 | 4,077 | +20.0% | +8.9% |
| EPS (円) | 310 | 261 | +18.8% | +7.9% |
主要な6つのビジネス領域に関する業績アップデート
2024年度上期の主要なビジネス領域の成長は、主に成長製品・新製品の力強い勢いが牽引しました。成長製品・新製品の売上収益は1兆1,270億円となり、CERベースで+18.7%の成長を遂げました。

財務ベース売上収益は6,952億円(CERベース:+7.6%成長)となりました。

財務ベース売上収益は3,887億円(CERベース:+5.3%成長)となりました。

財務ベース売上収益は5,357億円(CERベース:+14.3%成長)となりました。

財務ベース売上収益は2,850億円(CERベース:+18.7%成長)となりました。

財務ベース売上収益は381億円(CERベース:+107.0%成長)となりました。

財務ベース売上収益は3,146億円(CERベース:△12%減少)となりました。
2024年度業績予想およびマネジメントガイダンス
当社は、後発品によるVYVANSEの減少が想定より緩やかであったことと上期の力強いビジネスの勢いを背景に、2024年度通期マネジメントガイダンスを上方修正しました。さらに、2024年度の前提為替レートの更新を反映し、財務ベースおよびCoreベースの通期業績予想を上方修正しました。
2024年度マネジメントガイダンス(CERベースでのCore増減率)(IFRSに非準拠)
| 科目 | 当初マネジメントガイダンス (2024年5月公表) | 修正マネジメントガイダンス (2024年10月公表) |
|---|---|---|
| Core売上収益 | 横ばいからやや減少 | 横ばいからやや増加 |
| Core営業利益 | 約10%の減少 | 一桁台半ば%の減少 |
| Core EPS (円) | 10%台半ばの減少 | 約10%の減少 |
2024年度 業績予想
(億円、EPSおよび1株当たりの年間配当金を除く)
| 科目 | 2024年度 当初業績予想 (2024年5月公表) | 2024年度 修正業績予想 (2024年10月公表) |
|---|---|---|
| 売上収益 | 43,500 | 44,800 |
| Core 売上収益 (IFRSに非準拠) | 43,500 | 44,800 |
| 営業利益 | 2,250 | 2,650 |
| Core 営業利益 (IFRSに非準拠) | 10,000 | 10,500 |
| 当期利益 | 580 | 680 |
| EPS (円) | 37 | 43 |
| Core EPS (円) (IFRSに非準拠) | 431 | 456 |
| 調整後フリー・キャッシュ・フロー(IFRSに非準拠) | 3,500-4,500 | 4,000-5,000 |
| 1株当たりの年間配当金 (円) | 196 | 196 |

2024年度の株主向けWEBアンケートご協力のお願い
当社は、株主の皆さまからの貴重なご意見・ご要望を、コミュニケーション活動の参考としております。2024年度の株主向けWEBアンケートは、2024年11月29日~12月20日まで実施します。
多くの株主の皆さまのご協力をお願い申しあげます。
アンケートの回答には、株主番号の入力が必要となります。株主番号は、中間配当金計算書の右上に印字(8桁)されています。
