臨床試験(治験) | 武田薬品

臨床試験(治験)
タケダは、誠実さと透明性をもって臨床試験を進めています。タケダの臨床試験専用サイトを通じて、タケダが実施した、または実施している臨床試験の情報を公開し、患者さん、医療従事者、研究者など様々な方に向けて情報を提供しています。
臨床試験の実施計画書(プロトコル)や試験結果の概要の情報へのアクセスを提供し、臨床試験の透明性を高めます。このように、タケダはサイエンスのイノベーションを促し、医療の向上を目指すとともに、臨床試験に対する信頼の向上も図っています。
詳しくは、臨床試験情報専用サイトをご覧ください。
このウェブサイトは患者さんやそのご家族の皆さまに、治験、臨床試験に関する情報をよりわかりやすく理解いただくことを目的としています。
免責事項(ご覧いただく際にお読みください)
重要な情報ですので以下を読んでご理解のうえでこのサイトを閲覧ください。
このウェブサイトの目的
このウェブサイトは、タケダが実施した、または実施している日本国内の臨床試験の情報を日本語で公開することにより、患者さんやそのご家族を含む一般の方の臨床試験情報へのアクセスを拡大することを目的としています。
このウェブサイトに掲載されている臨床試験情報
タケダは、世界各国の法令や業界のガイドラインに従い、求められるすべての公的データベースに臨床試験の実施計画を登録し、試験結果の概要を公開しています。このウェブサイトに掲載されている臨床試験情報は、臨床研究実施計画・研究概要公開システム[jRCT]、一般社団法人日本医薬情報センターの臨床試験登録データベース[JapicCTI]、米国の臨床試験登録データベース[ClinicalTrials.gov]、またはその他のデータベースに公開されている情報の範囲内で作成されています。
このウェブサイトの情報の利用方法
このウェブサイトには、臨床試験の情報(未承認の情報を含む)が掲載されています。未承認の効能・効果、用法・用量等での医薬品の使用、販売促進またはその他の(直接的または間接的な)商業化は法令で禁止されていますが、このウェブサイト上の情報はこれを促進するものではありません。また、個々の臨床試験の情報が医薬品の効果とリスクの全体像を包括的に反映しているわけではありません。
特定の患者さんに特定の医薬品やワクチンが適切であるかどうかを医学的に判断できるのは医師のみです。このウェブサイトで入手した情報や特定の病態に関するご質問がある場合は、お近くの医師へご相談ください。
このウェブサイトには現在実施中の臨床試験の情報も掲載されていますが、臨床試験の参加者を募集することを意図したものではありません。臨床試験への参加に関しては日本の法規制(医薬品医療機器等法やGCP[Good Clinical Practice])により、当社による直接の参加案内はできません。
このウェブサイトは特定の医薬品や治療法等について、医療関係者や一般の方に向けた広告を目的としたものではありません。医療関係者の皆様におかれましては、処方を決定する際には、このウェブサイトで提供される情報ではなく、規制当局により承認を受けている効能・効果、用法・用量を、最新の添付文書でご確認ください。
上記をご理解、ご承諾のうえでサイトをご覧ください。
治験とは
治験ってなに?
薬が多くの患者さんに使われるようになるためには、「薬の候補」となる物質を選び出し、培養細胞や動物で薬としての効果や安全性を確かめる試験などを繰り返し、最終的に私たちヒトで作用・効果・安全性などを調べます。
このうち「薬の候補」が健康な成人や患者さんに対して与える効果や安全性、治療法(適正な投与量や投与方法)などを確認する目的で行われる試験のことを「治験」といいます。
製薬会社は「治験」の結果を厚生労働省に申請し、薬として承認されてはじめて、多くの患者さんに安心して使われるようになります。
今、私たちが使っている薬はこれまで治験にご協力頂いた、大勢の患者さんやご家族の協力によって誕生したもので、いわば「先人からの贈り物」です。これから誕生する薬は未来の世代へ受け継がれていく貴重な財産となります。
メリット
- 通常の治療よりも詳細な診察や検査が行われ、病気の状態や検査結果について詳しく説明を受けられます。
- 新しい治療を受ける機会があります。
- 将来病気で苦しむ患者さんの治療に役立つ「新しい薬」を誕生させるという社会貢献に繋がる可能性があります。
- 治験によっては検査代や診療費が通常より少なくなる場合があります。
注意点
- 治験中は体調に変化がないか慎重に診察するため、いつもより来院回数や検査頻度が多くなることがあります。
- 適切に対処される体制ではありますが、副作用が出る可能性があります。
参加する人の自由意思により、いつでもやめることができます。また、途中でやめた場合も、通常の診療を継続して受けることができます。参加をやめたことにより、今後の治療に不利益を受けることはありません。不安なことがありましたら、治験担当医師やCRC(治験コーディネーター)などにお申し出ください。
治験に参加する人のプライバシーや人権は厳重に守られることが、薬機法やGCPという法律や治験のルールによって定められています。治験の結果は資料として利用されますが、参加した人の個人情報が公表されることはありません。また治験が正しく行われているかを確かめるために、製薬会社や厚生労働省が、カルテや検査データなどを確認することがありますが、その場合でも氏名や住所などの個人情報は公開されません。いかなる場合も、個人を特定できることはなく、プライバシーは守られます。
- 薬機法:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律
- GCP:医薬品の臨床試験の実施の基準に関する省令(Good Clinical Practice)
新薬を生み出す「治験」ってナンダ?
詳しく見る

治験に参加してみて 〜肺がん患者さんのご経験〜
詳しく見る

リモート治験ってナンダ?
詳しく見る
治験の情報

治験、臨床試験についてのよくある質問
治験、臨床試験についてよくある質問をまとめています。
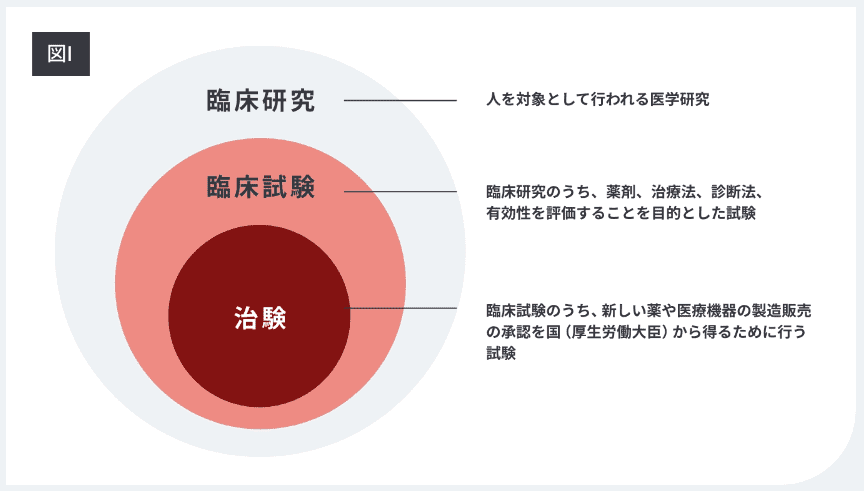
ヒトを対象として行われる医学研究のことを「臨床研究」といいます。臨床研究のうち、薬剤、治療方法、診断方法等の効果や安全性を明らかにする研究を「臨床試験」といいます。
臨床試験は通常の治療と異なり、研究的な側面が伴います。患者さんの新しい治療法を発見し、健康を改善するのに役立ちますので、公衆衛生にとっても非常に重要な取り組みです。
臨床試験は正しく行われなければ、参加された方の安全や人権を損ねることになります。そのようなことを防ぐため、臨床試験は国が定めた法令や基準に従って行われることになっており、患者さんの自由意思にもとづく同意をいただいたうえで行われます。
すべての臨床試験の参加者の個人情報は、法律にもとづき保護され、匿名でしか使用されません。参加者の秘密保持は厳重に行われ、参加者のプライバシーが維持されることを確実にするために多くの措置が講じられています。
図Ⅰ(出典: https://new-ing.jp/about_faq )
薬の研究開発は、まず最もふさわしいと期待される物質を選ぶことから始まります。
研究室で新しい物質を作ったり、天然に存在するたくさんの物質の中から薬の候補を選び出したりした後、国が定めた法令や基準に沿って、研究室で有効性や安全性などについて調べます。ただしこの段階では、すぐに薬として使うことはできません。
その薬の候補が、本当に、ヒトに対して安全なのか、効果があるのか、病気の治療に役立つかどうかを調べるためには、最終段階で患者さんに使っていただいて調べなければなりません。
この手順は従来から、日本、アメリカ、ヨーロッパなど多くの国で一般的に採用されており、現在市販されている多くの薬はこのような手順によってヒトでの有効性や安全性などが確認されてきました。このような手順を踏んで多くの新しい薬が開発され、病気の診断や治療に貢献しています。
治験は製薬会社、または医師が主導し実施します。主導がどちらであるにしろ、実際に治験の計画で定められた投薬・診察・検査などを実行するのは医療機関の医師です。
治験は製薬会社、または医師が主導し実施します。主導がどちらであるにしろ、実際に治験の計画で定められた投薬・診察・検査などを実行するのは医療機関の医師です。

第1相臨床試験
健康な成人を対象とし、 治験薬の安全性を調べる。
体内での薬剤の動きや代謝につ いて調べる。主に健康な成人を 対象に、治験薬の成分がどのよ うに体に吸収・代謝・排泄され るかなどの安全性を調べます。 ※一部疾患の治験においては、患者さ んを対象に行う場合があります。

第2相臨床試験
少数の患者さんを対象とし、治験薬の用法と用量を調べる。
効果と安全性が得られる用法と 用量を調べる。少数の患者さん を対象に治験薬を使用してもら います。量やタイミングを変化さ せながら、得られる効果や副作 用の有無なと・を調べます。
第3相臨床試験
多数の患者さんを対象とし、治験薬の効果を調べる。
より多数の患者さんに治験薬を 使用してもらいます。治験薬と プラセホ(薬の成分がまったく 入っていない偽薬)などを比べ て、治験薬の効果か優れているか や、安全性などを検証します。
※治験は「医薬品の臨床試験の実施の基準に関する省令」(GCP省令)というルールに則って行われ、参加・協力してくたさる方の人権と安全を最優先に実施されています。 ※また治験を行う医療機関についても、G(P省令で定められた要件を満たす病院のみで実施することができます。医療設備が充分に整っていることに加え、責任を持って治験を実施する医師や看護師、薬剤師などがそろっていること、治験の内容を審査する委員会を利用できること、緊急の場合にはすぐに必要な治療や処置が行えることが要件となっています。
製薬企業は、治験の結果を取りまとめ、治験薬の品質や治験に入る前の研究段階での資料などとともに、国(PMDA*)に提出します。効果や安全性・適切な使い方などについて審査が行われ、審査の結果、国(厚生労働大臣)から承認されてはじめて「治験薬」から「医薬品」となり、多くの患者さんへ使われることになります。
第1相臨床試験から第3相臨床試験のあと、第4相臨床試験という段階もあります。
新薬が医薬品として国(日本では厚生労働省)に承認されると、治験を実施した製薬会社に対して、医薬品の安全性、有効性、最適な使用法に関する追加情報を国から集めるよう求められることがあります。この追加情報を収集するための医薬品承認後の臨床試験が第4相臨床試験とよばれるものです。
治験は新しい薬を生み出すプロセスとしてだけでなく、すでに承認されている薬の適応拡大(他の疾患でも使えるようにする)などでも行われます。
*PMDA(医薬品医療機器総合機構)は、厚生労働省所轄の独立行政法人であり、医薬品と医療機器の承認審査・安全対策や健康被害の救済などを行っています。
治験、臨床試験が現在準備中か、実施中かまたは試験が計画通り完了しているかなどの進捗具合のことです。このサイトでご覧いただける治験、臨床試験の実施状況には、以下のものがあります。
「準備中」:まだ治験、臨床試験は開始されていません。 「実施中」:治験、臨床試験を開始しました。現在、治験、臨床試験を行っている状況です。 「完了」:治験、臨床試験が終了しました。
治験、臨床試験を検索すると、最初に試験のタイトルを検索結果としてご覧いただけます。これはその治験、臨床試験に関係する疾患名や試験のフェーズの情報を含みます。また、試験のタイトルをクリックすると治験、臨床試験の詳細の情報としてデザイン、評価項目、参加基準、実施期間、実施状況や実施医療機関の情報をご覧いただくことができます。
タケダは治験、臨床試験の終了後に試験の結果を公開しています。それぞれの治験、臨床試験ページの「臨床試験の結果」に表示しているウェブサイトClinicalTrials.Takeda.comからご覧ください。他にも臨床研究実施計画・研究概要公開システム「jRCT」に日本語と英語で、米国の臨床試験登録データベース「ClinicalTrials.gov」に英語で試験結果の概要を公開しています。これらのウェブサイトに掲載される内容は、試験結果の概要を掲載しており、その薬の有効性、安全性や薬物動態およびその他の結果が含まれますが、参加者ごとのデータや個人情報は含まれません。
治験は、参加者への治験の説明と同意取得、治験実施期間、治験結果の解析といった、大きく3つのステップで実施します。正しく安全に実施するため、参加者の自由意思にもとづく同意をいただいたうえで、治験担当医師をはじめとした様々な専門家の関わりのもとに行い、治験終了後は治験薬の評価を経て、新薬の承認へと進んでいきます。
医療機関で治験実施の準備が整うと、最初に行うのが候補となりそうな患者さんの選定です。治験担当医師が、治験の目的や条件に当てはまると考えられる患者さんに、治験の参加に協力していただけるかどうかをおたずねします。患者さん自身で治験情報を収集して参加を希望される場合もあります。
治験を実施している医療機関で、治験担当医師や治験コーディネーターから、治験の目的、方法、参加期間、予測される治験薬の効果及び予測される被験者に対する不利益などわかりやすく書かれた説明文書とともに、詳しい説明が行われます。説明を受けて、分からないことや不明なことがあれば、どんなことでも質問することができます。
説明内容を理解し、患者さん自身の自由な意思で治験に参加することを決められた後に、同意文書に署名し、次のステップに進みます。
「治験ってなに?」ページもご覧ください。
治験に参加することが決まると、血液検査、心電図やレントゲンなどの結果をみて、条件に合致するか判断されます。治験参加への適合性に問題が無ければ、治験が開始されます。
治験薬を服用していただき、その効果、体調の変化、副作用の有無などが確認されます。治験薬は飲み薬や注射など様々あり、治験担当医師の指導の下で投与されます。治験期間中は治験担当医師による定められた検査(採血や心電図測定など)、定期的な診察、効果の確認や副作用が現れていないかの確認を行います。副作用が出た場合は治験を中止することもあります。
治験がどのくらいの期間続くのかは、治験によって異なります。1週間程度の短いものから、1年以上にわたるものまであります。
治験期間中、治験参加者の方々から得られるさまざまなデータが一カ所に集められ、有効性や安全性の解析が行われます。解析の後、治験に入る前の研究段階や治験での結果、さらにはその治験薬の品質などの情報が集められ、申請資料にまとめられます。製薬企業は、その申請資料を国に提出し、審査されます。厚生労働大臣の承認がおりると、医薬品としての提供が可能となります。
治験は安全性に十分に配慮された計画にもとづいて行われます。
治験の実施は、「安全に実施すること」に重点が置かれています。それでも予期しない副作用が発現した際には、すぐに医療機関が対応できる体制が整えられています。また、国(厚生労働省)が定めたルールや国際的なルールの中で、治験参加者の人権・安全を守り、科学的に適正に実施しなくてはいけないと定められており、様々な背景を持つ方で構成される委員会で実施に関して了承を得た上で行われます。さらに、治験の実施のためには国にその実施を届け出ることが義務付けられています。
治験に参加するにあたっては、治験の特徴や利益・不利益などが十分に説明され、参加の判断や途中での参加中止など、参加者の自由な意思が尊重されます。
「治験ってなに?」ページもご覧ください。
基本的には使うことはできません。
ただし治験薬によっては、長期間使用した場合の有効性・安全性を検証する治験計画を別途設けている場合があり、長期使用の治験に改めて参加することで、使用が可能になるケースがあります。
治験薬の有効成分が入っていない薬のことです。
日本語では「偽薬(ぎやく)」と訳され、「外見」「重さ」「味」など、見た目だけでは本当の治験薬と区別がつかないようにブドウ糖や乳糖などで作られています。治験では治験薬とプラセボを比較することで、その結果により治験薬が科学的に有効であることを証明する手段になっています。
法律で守秘義務が課されています。
治験実施医療機関の職員や製薬企業の社員に対して、治験参加者の情報に関する守秘義務が法律で課されており、治験に参加される方のプライバシーは、厳重に守られます。また医療機関から製薬企業に渡される治験参加者のデータは、名前や住所などの情報がコード番号に置き換えられていますので、個人を直接特定することはできないようになっています。
「治験ってなに?」ページもご覧ください。
治験コーディネーターなどもサポートしてくれます。
医師以外に、看護師、薬剤師、治験コーディネーター(CRC)と呼ばれるスタッフがサポートをしてくれます。CRCは治験に参加される方の相談窓口となります。治験薬や治験の進め方の説明、診察や検査などへの立ち会い、スケジュール調整などを行います。困ったことや心配なことがあればいつでも相談することができます。
治験の中止・続行といった判断は、治験参加者の意思が尊重されます。
副作用などが起きた場合、治験を中止するケースもあります。また治験をやめたいと思った時も、いずれのタイミングにおいても医師や治験に関わるスタッフへ告げることでやめることができます。治験への参加を途中でやめても、これまで通りの治療を受けることができます。
「治験ってなに?」ページもご覧ください。
このウェブサイトについてのよくある質問
タケダは、世界各国の法令や業界のガイドラインに従い、求められるすべての公的データベースに治験、臨床試験の実施計画を登録し、試験結果の概要を公開しています。このウェブサイトに掲載されている臨床試験情報は、臨床研究実施計画・研究概要公開システムjRCT、米国の臨床試験登録データベースClinicalTrials.gov、またはその他のデータベースに公開されている情報の範囲内で作成されています。
このウェブサイトは、タケダが実施した、または実施している日本国内の治験、臨床試験の情報を日本語で公開することにより、患者さんやそのご家族を含む一般の方の治験、臨床試験情報へのアクセスを拡大することを目的としています。
なお、タケダはClinicalTrials.Takeda.comに、少なくとも2005年1月1日以降に承認を受けた医薬品の介入試験の結果の概要を掲載するよう努めています。タケダのグローバル全体(日本も含む)における治験、臨床試験の情報(計画情報、試験結果の概要)をご覧になりたい方はこちらのサイトにアクセスして下さい(英語のみ)。
このウェブサイトは、治験、臨床試験の情報を公開する目的で設置しています。未承認の薬の販売促進・広告、治験、臨床試験の参加者を募集する目的ではありません。そのため、このウェブサイトを通じた、治験、臨床試験の参加に関するお問い合わせについては、日本の法規制(医薬品医療機器等法やGCP[Good Clinical Practice])によりお受けできません。
しかし、一定の条件や手続きが済んだ一部の治験、臨床試験については、参加をご希望の方のために別途、参加者を募集するためのウェブサイトを準備しています。治験、臨床試験への参加をご希望の方はそちらのウェブサイトからお手続きください。
なお、治験、臨床試験の参加者を募集する場合には、参加者用の募集広告としてあらかじめその募集・広告の手順や方法、利用ウェブサイト、広告の内容等を、法律的、倫理的、科学的な観点で第三者の審査委員会で審査いただき、治験、臨床試験が実施される医療機関の了解を得ることが法令で定められています。ご覧いただく治験、臨床試験の情報の「その他の情報」の部分に別のウェブサイトのリンクが表示されていることがあります。その場合、このウェブサイトは治験の参加者募集広告として利用することが法令上認められています。
このウェブサイトにはどの医療機関でその治験、臨床試験が実施されているかについても公開しています。この情報を参照し、医療機関にお問い合わせいただくことは制限しておりません。
その他のことは「治験、臨床試験について」もご覧ください。
タケダの治験、臨床試験に関する情報は、さまざまな情報源から入手することができます。
このウェブサイトの他にタケダはグローバル全体(日本を含む)でClinicalTrials.Takeda.comというウェブサイトを開設しています(英語のみ)。このウェブサイトの主な目的は、世界中の臨床試験データベースやその他の情報源から入手可能なタケダが実施する治験、臨床試験の情報を統合し、タケダの治験、臨床試験情報への透明性を高め、アクセスを強化することです。こちらのサイトには少なくとも2005年1月1日以降に承認を受けた医薬品の介入試験の結果の概要を掲載するよう努めています。タケダのグローバル全体(日本も含む)における治験、臨床試験の計画情報、試験結果の概要をご覧になりたい方はこちらのサイトにアクセスして下さい。
タケダは、世界各国の法令や業界のガイドラインに従い、求められるすべての公的データベースに治験、臨床試験の実施計画を登録し、試験結果の概要を公開しています。日本で実施された治験、臨床試験の実施計画と試験結果の概要については、日本語と英語で臨床研究実施計画・研究概要公開システムjRCTに実施計画を登録し、試験結果の概要を公開しています。 また、タケダはポリシーとして全ての介入試験について米国の臨床試験登録データベースClinicalTrials.govに治験、臨床試験を掲載することとしており、日本で実施された治験、臨床試験についてもこのデータベースに実施計画を登録し、試験結果の概要を公開しています。
用語集
治験、臨床試験についての用語を説明しています。
薬が多くの患者さんに使われるようになるためには、「薬の候補」となる物質を選び出し、培養細胞(ばいようさいぼう)や動物で薬としての効果や安全性を確かめる試験などを繰り返し、最終的に私たちヒトで作用・効果・安全性などをしらべます。
このうち「薬の候補」が健康な成人や患者さんに対して与える効果や安全性、治療法(適正な投与量や投与方法)などを確認する目的で行われる試験のことを「治験」といいます。
治験は、未来の治療の選択肢を増やすことにつながります。詳しくは「治験ってなに?」ページをご覧ください。
ヒトを対象として行われる医学研究のことを「臨床研究」といいます。臨床研究のうち、薬剤、治療方法、診断方法等の効果や安全性を明らかにする研究を「臨床試験」といいます。
臨床試験は通常の治療と異なり、研究的な側面が伴います。患者さんの新しい治療法を発見し、健康を改善するのに役立ちますので、公衆衛生にとっても非常に重要な取り組みです。
臨床試験は正しく行われなければ、参加された方の安全や人権を損ねることになります。そのようなことを防ぐため、臨床試験は国が定めた法令や基準に従って行われることになっており、患者さんの自由意思にもとづく同意をいただいたうえで行われます。
すべての臨床試験の参加者の個人情報は、法律にもとづき保護され、匿名でしか使用されません。参加者の秘密保持は厳重に行われ、参加者のプライバシーが維持されることを確実にするために多くの措置が講じられています。
治験、臨床試験は、試験の目的および特徴にもとづいて様々な段階に分けられ、「フェーズ(治験、臨床試験の相)」とよんでいます。新薬の開発や治療において重要な役割を果たします。
第1相臨床試験は、健康な方を対象として行われることが多く、薬の安全性の評価に重点を置いて実施されます。第1相臨床試験の目的は、最もよくみられる重篤な有害事象を明らかにすることです。また、薬が体内に入ってどのように変化し、排泄されるかもよく評価されます。
第2相臨床試験は、有効性と安全性に関しておよその見当をつけるための試験や薬の適切な使用量を推定するための試験です。薬の有効性に関するデータを収集し始めた段階で、実際の患者さんを対象に実施されます。有効性とは、その薬の対象となっている病気、疾患や病態をコントロールするのにどの程度有効であるかをいいます。また、薬が安全であるかの評価を継続し、有害事象の短期的なモニタリングも行います。
第3相臨床試験は、有効性と安全性を確認するための比較試験(プラセボまたは類似薬がすでにある場合にはそれとの比較試験)です。第3相臨床試験では、実際の医療機関で薬を使っていただくことを目的により多様な参加者(患者さん)の集団で、異なる用量で臨床試験を行うことにより、薬の安全性および有効性に関するより多くの情報を収集します。適切な評価のために、参加者に他の医薬品と併用して薬を投与することもあります。
新薬が医薬品として国(日本では厚生労働省)に承認されると、治験を実施した製薬会社に対して、医薬品の安全性、有効性、最適な使用法に関する追加情報を国から集めるよう求められることがあります。この追加情報を収集するための医薬品承認後の臨床試験が第4相臨床試験とよばれるものです。
プラセボは、有効成分を含みませんが、治験、臨床試験で実際に試験される薬と同じ外観および味に作られた物質です。プラセボは薬のように見えますが、有効成分を含んでいないため、「ダミーピル(ダミー錠)」又は「シュガーピル(砂糖錠)」と呼ばれることもあります。
治験、臨床試験の計画として、一部の参加者の方がプラセボを投与する群に割り当てられることがありますが、このような試験を「プラセボ対照試験」と呼び、このプラセボを投与される参加者のまとまり(集団)を対照群と呼びます。
対照群を治験、臨床試験の計画として設定することで、治験、臨床試験の担当医師が、治験、臨床試験中に認められた身体の変化(効果や副作用など)が実際の薬によるものか、治療によるものであるかどうか、またはプラセボを実際の薬を投与していると間違って脳が思い込んでしまった場合の反応によるものかどうかの判断に役立ちます。
治験、臨床試験でヒトに投与される薬を指す専門用語です。その薬が未承認である場合、治験薬は一般的にその化合物名やコード番号で呼ばれます。
「介入」とは、研究目的で、人の健康に関する様々な事象に影響を与える要因(健康の保持増進につながる行動および医療における傷病の予防、診断または治療のための投薬、検査等を含む)の有無または程度を制御する行為(通常の診療を超える医療行為であって、研究目的で実施するものを含む)をいいます。
「介入試験」とは、薬の有効性、安全性またはその他の情報、あるいは既に市販されている医薬品の新規使用を評価することを目的とした治験、臨床試験です。治験、臨床試験の参加者にどのようにして介入が割り当てられるかは試験の実施計画書にあらかじめ記載されます。このウェブサイトに掲載されている試験の大半は介入試験です。
日本の臨床試験登録データベースjRCTで登録された各治験、臨床試験に割り当てられた固有の識別番号(試験ID)です。試験IDのフォーマットは常に同じで、アルファベット「jRCT」の後に10桁の数字が続きます。
検索の時に試験IDを覚えておく必要はありませんが、特定の治験、臨床試験をお探しの場合は、IDによって迅速に情報を検索することができます。また、試験IDは、特定の臨床試験について担当の医師と話し合いたい場合にも役立ちます。
なお、日本製薬工業協会からjRCTでの治験の検索方法や検索結果の閲覧方法などを紹介する資料「治験の探し方 ~jRCTのみかた~」が公開されていますのでこちらもご参照ください。
日本の臨床試験登録データベースJapicCTIで登録された各治験、臨床試験に割り当てられた固有の識別番号(試験ID)です。試験IDのフォーマットは常に同じで、アルファベット「Japic-」の後に6桁の数字が続きます。
検索の時に試験IDを覚えておく必要はありませんが、特定の治験、臨床試験をお探しの場合は、IDによって迅速に情報を検索することができます。また、試験IDは、特定の治験、臨床試験について担当の医師と話し合いたい場合にも役立ちます。
なお、2023年3月にJapicCTIはjRCTに統合されたため、治験、臨床試験の情報の公開を終了しており、現在はみることができません。
米国の臨床試験登録データベースClinicalTrials.govで登録された各治験、臨床試験に割り当てられた固有の識別番号(試験ID)です。試験IDのフォーマットは常に同じで、アルファベット「NCT」の後に8桁の数字が続きます。
検索の時に試験IDを覚えておく必要はありませんが、特定の臨床試験をお探しの場合は、IDによって迅速に情報を検索することができます。また、試験IDは、特定の治験、臨床試験について担当の医師と話し合いたい場合にも役立ちます。
治験、臨床試験が現在準備中か、実施中かまたは試験が計画通り完了しているかなどの進捗具合のことです。このサイトでご覧いただける治験、臨床試験の実施状況には、以下のものがあります。
「準備中」:まだ治験、臨床試験は開始されていません。 「実施中」:治験、臨床試験を開始しました。現在、治験、臨床試験を行っている状況です。 「完了」:治験、臨床試験が終了しました。
医療機関ごとに将来募集する予定であるか、現在参加者を募集しているか、または募集期間が終了したかを示しています。
「募集前」:まだ参加者の募集をしていません。これから募集の予定です。 「募集中」:現在、参加者を募集しています。 「募集終了」:参加者の募集を終了しました。
臨床研究 オプトアウト
タケダでは、「人を対象とする生命科学・医学系研究に関する倫理指針」に従い、既存試料・データを新たな研究目的で使用する場合は、対象となる患者さんから直接同意を受けない場合があります。この場合、試験内容を情報公開させて頂き、患者さんから拒否できる機会を設けております。このような方法を『オプトアウト』といいます。 ご自身の既存資料・データが使用されることを望まない方は、オプトアウト欄を参照し、お問い合わせ先にご連絡ください。
オプトアウトを実施している臨床研究は下記の通りです。
| 臨床研究名 | オプトアウト |
|---|---|
| 「RAS遺伝子(KRAS/NRAS遺伝子)野生型で化学療法未治療の切除不能進行再発大腸癌患者に対するmFOLFOX6 + ベバシズマブ併用療法とmFOLFOX6 + パニツムマブ併用療法の有効性及び安全性を比較する第III相無作為化比較試験(PARADIGM試験)」データのARCADアジアへのデータ提供 | タケダは、ARCADアジア プロジェクトに賛同し、PARADIGM試験データを提供しております。こちらのリンクを参照ください。 データの提供および利用の内容や範囲、オプトアウト等についてはこちらのリンクをご参照ください。 |
| 「RAS遺伝子(KRAS/NRAS遺伝子)野生型で化学療法未治療の切除不能進行再発大腸癌患者に対するmFOLFOX6 + ベバシズマブ併用療法とmFOLFOX6 + パニツムマブ併用療法の有効性及び安全性を比較する第III相無作為化比較試験(PARADIGM試験)」 及び 「RAS遺伝子(KRAS/NRAS遺伝子)野生型で化学療法未治療の切除不能進行再発 大腸癌患者に対するmFOLFOX6 + ベバシズマブ併用療法と mFOLFOX6 + パニツムマブ併用療法の有効性及び安全性を比較する 第III相無作為化比較試験における治療感受性、予後予測因子の探索的研究」 データのNCCE (National Cancer Center East) 及び GONO (Gruppo Oncologico Nord-Ovest)への提供 | タケダは、NCCE (National Cancer Center East) とGONO (Gruppo Oncologico Nord-Ovest) が実施する以下の研究に賛同し、PARADIGM試験データの一部を提供しております。 1.”ミスマッチ修復欠損を有さないRAS/BRAF野生型の転移性大腸癌患者におけるHER2過剰発現/増幅の有無による最適な一次薬物療法を評価する国際共同メタアナリシス (Investigating the best first-line targeted agent and chemotherapy backbone for pMMR RAS/BRAF wild-type metastatic colorectal cancer patients according to HER2 overexpression /amplification: individual patients data-based metanalysis of 8 randomized trials)”この研究へのデータの提供および利用の内容や範囲、オプトアウト等についてはこちらのリンクをご参照ください。 2.“ミスマッチ修復欠損を有さないRAS/BRAF野生型の転移性大腸癌患者における腫瘍占拠部位による最適な一次薬物療法を評価する国際共同メタアナリシス(Investigating the best first-line targeted agent and chemotherapy backbone for RAS/BRAF wild-type metastatic colorectal cancer patients according to tumor sidedness: individual patients data-based metanalysis of 11 randomized trials)”この研究へのデータの提供および利用の内容や範囲、オプトアウト等についてはこちらのリンクをご参照ください。 |
お問い合わせ先
この臨床試験情報に関するお問い合わせはこちらのフォームまでお願いします。
*臨床試験への参加のご要望や病気のご相談などは薬事関係法令上、受け付けていませんので主治医の先生にご相談ください。
